医械书籍推荐 |图说中国医疗器械注册申报法规 第2版
出版介绍:
出版社: 中国医药科技出版社
ISBN: 9787521441642
作 者: 国家药品监督管理局医疗器械技术审评中心
出版时间: 2023年12月
开本:16开
页数:688页
原价:198元/册
书籍介绍:
过去五年,是我国医疗器械审评审批事业大成长、大发展、大进步的五年。五年来,我们始终坚持“以人民为中心,保护和促进公众健康”的初心使命,始终围绕“创新、质量、效率、体系、能力”五大主题,全力推进审评审批制度改革,持续优化审评审批流程,建立医疗器械审评质量管理长效机制,树立科学审评理念,持续鼓励医疗器械研发创新,形成了中国式现代化医疗器械审评体系1.0版。当前,面对新时代新阶段医疗器械监管工作的新要求,面对推进中国式现代化的重大使命,面对世界百年未有之大变局带来的新挑战和新机遇,为全面推进监管体系和监管能力现代化,着力破解医疗器械产业发展面临的“卡脖子”问题,加快推动更多国产高端、临床急需医疗器械产品上市,助力国家重大区域发展战略,国家药品监督管理局医疗器械技术审评中心在上一版的基础上组织编写了本书,从注册资料方面介绍了医疗器械注册申报或备案相关法规、规章,并梳理了器审中心各类审评审批事项,进一步提高工作效率和透明度,切实增进人民群众福祉,推进健康中国建设。
本书通过图文结合的方式对注册申报流程进行了介绍,语言通俗易懂,可作为医疗器械企业科普读物。同时,医疗器械监管部门、检测机构及行业相关人员亦可阅读学习。
书籍编委:
书籍目录:
第一章 绪论
1.医疗器械行政许可事项概述.........1
2.医疗器械注册和备案概述.........3
3.信息态询.........4
4.参老资料.........4
第二章 注册流程
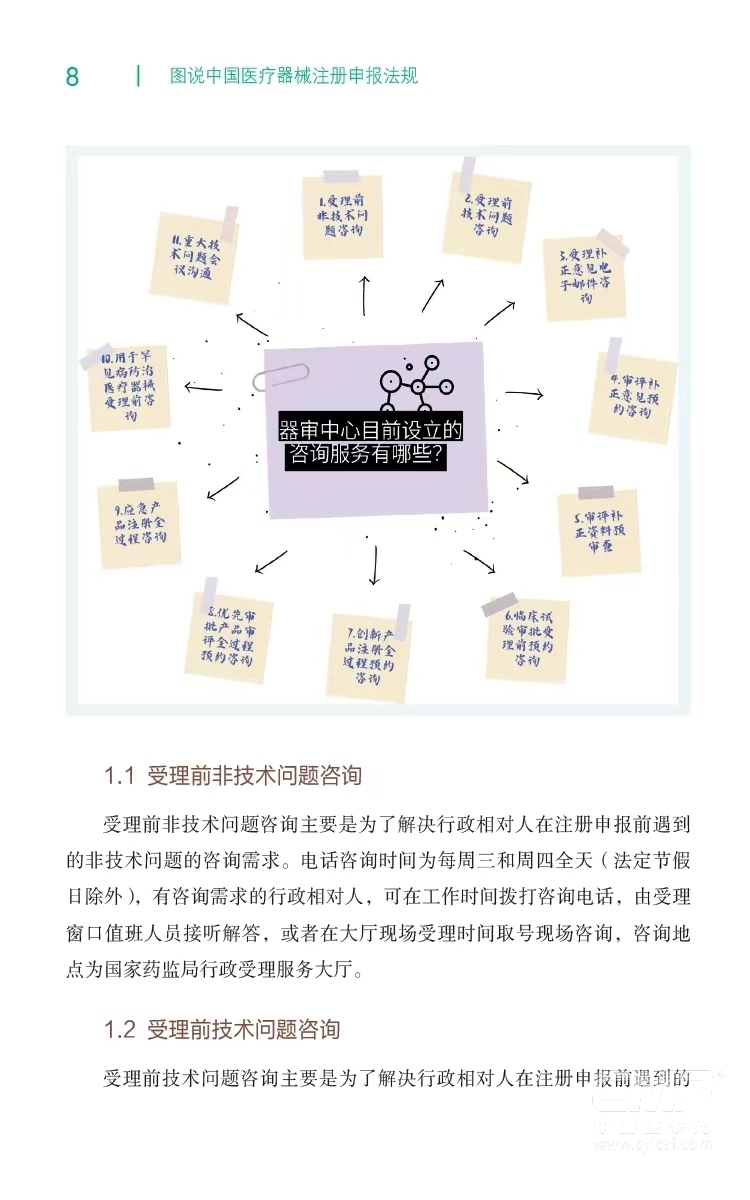
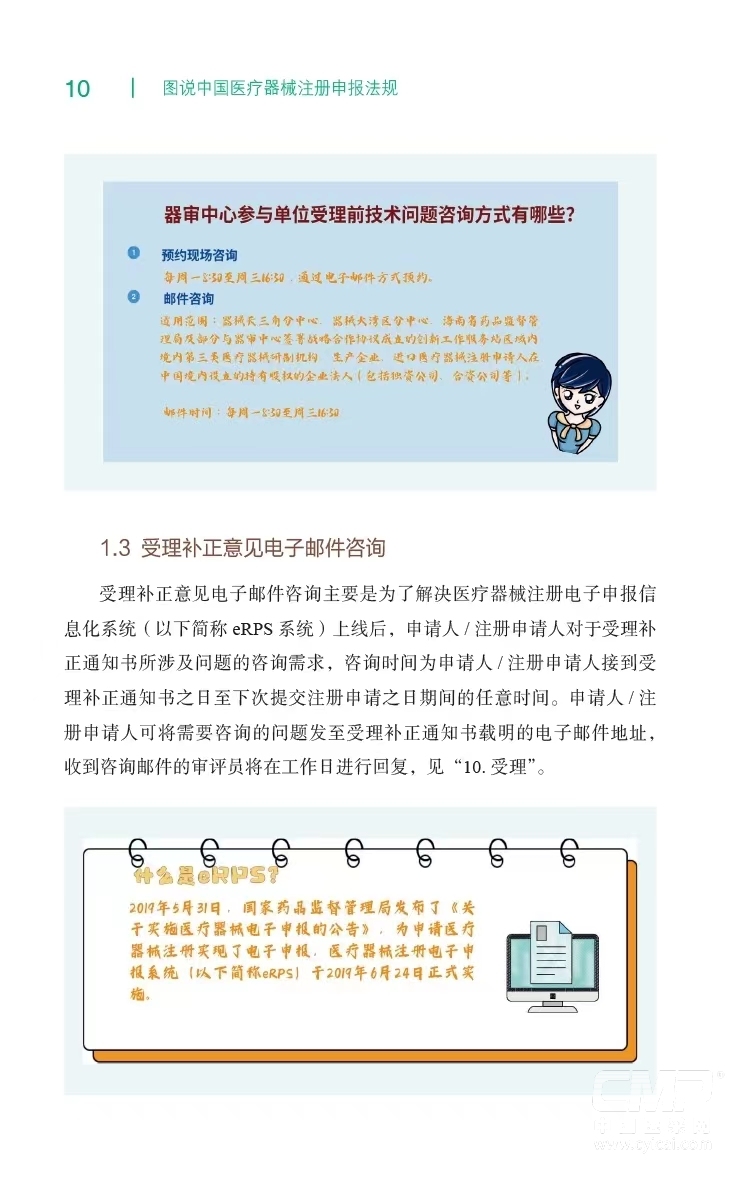
1.咨询服务 .........7
2.产品命名及注册单元划分.........14
3.分类.........19
4.产品检验......... 25
5.临床评价 .........30
6.创新医疗器械特别审查.........57
7.优先审批.........69
8.应急审批 .........76
9.注册和备案由报资料准备 ......... 80
10.受理..........88
11.审评审批.........95
12.注册质量管理体系核查.........103
13.补充资料.........108
14.专家咨询.........119
15.延续注册.........122
16.变更注册/变更备案.........127
17.说明书更改告知.........134
18.其他.........138
第三章 注册范本示例
1.医疗器械安全和性能基本原则清单范本.........147
2.综述资料范本 .........179
3.非临床资料范本 .........183
4.医疗器械产品技术要求范本 .........191
5.符合性声明范本.........197
6.代理人委托书范本.........198
7.体外诊断试剂说明书范本.........199
附录 医疗器械制度文件汇总
医疗器械监督管理条例
205(中华人民共和国国务院令第 739号) .........205
医疗器械注册与备案管理办法
(国家市场监督管理总局令第47号) .........235
体外诊断试剂注册与备案管理办法
(国家市场监督管理总局令第 48号) ......... 258
书籍预览:


原价:198元/册 ,现订阅价格:168元/册
扫描下方二维码直接购买


